Your privacy is very important to us. When you visit our website, please agree to the use of all cookies. For more information about personal data processing, please go to Privacy Policy.


辉大基因眼科药物HG004完成国际多中心临床1/2期的首例受试者给药
•HG004是中国首个使用同一主方案开展国际多中心临床研究的AAV基因治疗药物,用于RPE65突变相关遗传性视网膜营养不良的治疗
•HG004是中国首个自主研发的同时获得美国FDA授予孤儿药(ODD)和儿科罕见病资格(RPDD)双认证的眼科基因疗法药物
•HG004是辉大基因丰富眼科和神经领域基因疗法产品管线中首个进入注册临床阶段的产品
2023年11月02日,专注于基因编辑技术和基因治疗药物开发、处于临床阶段的全球性生物技术公司——辉大(上海)生物科技有限公司(简称“辉大基因”)今日宣布,中国首个使用同一主方案开展国际多中心临床1/2a期 “STAR星”(Safety and efficacy Trial of HG004 for leber congenital Amaurosis related to Rpe65 gene mutations)试验 (临床备案号NCT05906953或CTR20232920)的基因治疗药物HG004顺利完成首例受试者给药。 HG004是一种由腺相关病毒9型(AAV9)递送的基因替代疗法候选药物,用于治疗由RPE65突变引起的遗传性视网膜营养不良(RPE65-IRD)。
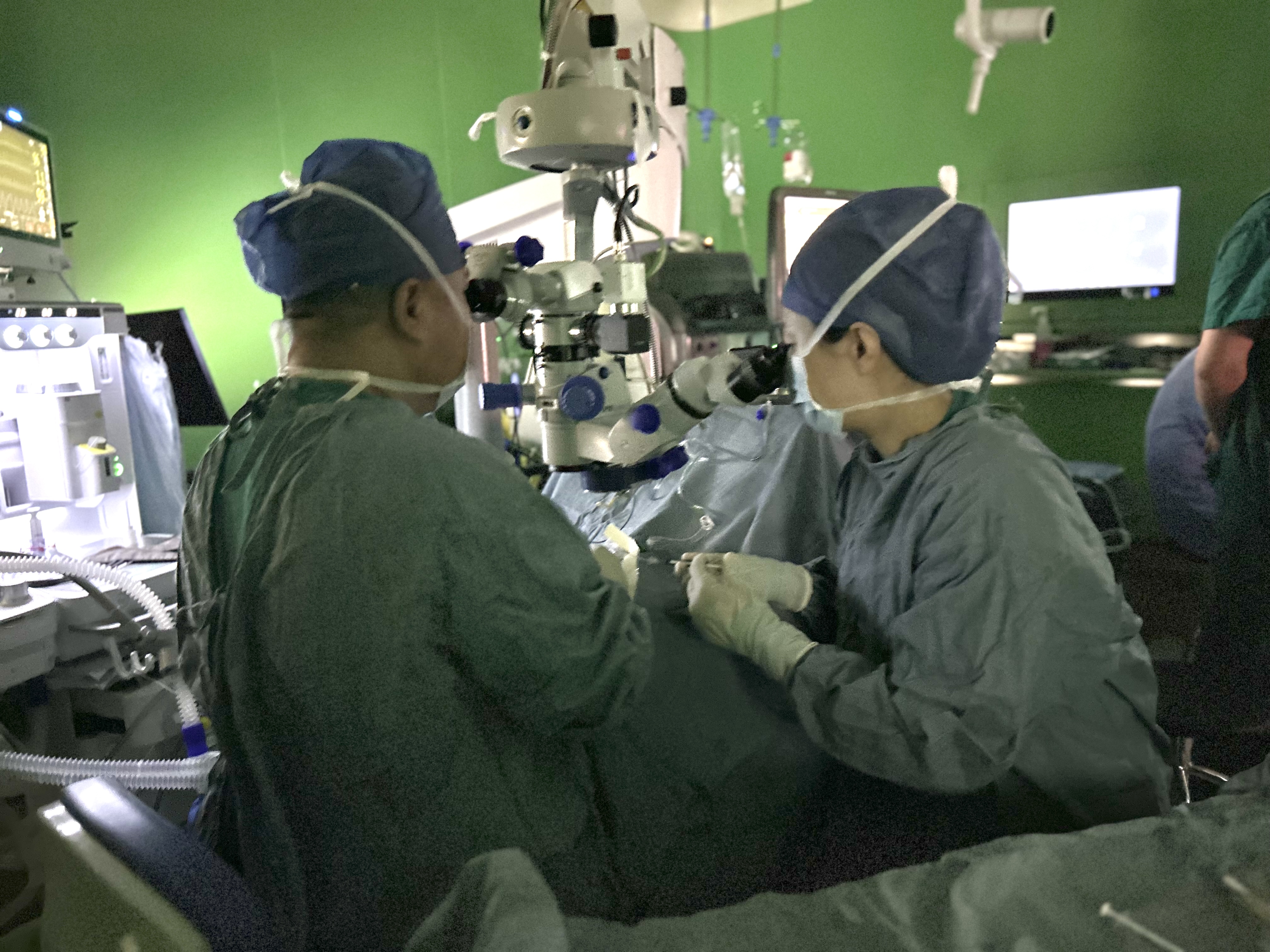
Professor Zhao Peiquan's team from Xinhua Hospital completed the First-Patient-Dose
“以往使用AAV2来治疗RPE65相关视网膜疾病的基因疗法,都需要较高的载体总剂量和较大的注射量,这会引起潜在的安全性问题,包括视网膜脱离等。”辉大基因联合创始人兼首席执行官陆英明博士说,“我们使用的HG004,可以对视网膜色素上皮细胞层实现更高效地转导,从而降低总载体剂量和注射量,这一点已在HG004治疗成人和儿童莱伯氏先天性黑矇(LCA2)的临床试验(HG00401临床研究)中得到验证。正如美国FDA的建议,这种疗法也有潜力用于治疗RPE65突变相关的遗传性视网膜疾病(RPE65-IRD),全球有55000多名RPE65-IRD患者,临床需求巨大。辉大基因团队对这一重要里程碑感到振奋,我们正在与中美的临床机构密切合作,为全球RPE65-IRD患者群体努力开发一种更安全、疗效更好的‘一次给药,长期有效’疗法。”
HG004是由辉大基因自主研发的基因治疗药物,采用基因替代策略,使用重组AAV9载体递送正常的RPE65基因到视网膜,以修复、治疗和预防成人及儿童的RPE65-IRD疾病。HG004今年已被美国FDA授予了孤儿药和儿科罕见病药物资格认定。HG004治疗LCA2的首个临床研究HG00401已顺利完成全部患者给药,成人和儿童受试者的视力均有显著改善,且未观察到安全性问题。
“继10月24日IIT研究完成最后一例受试者给药后,本周顺利完成HG004国际多中心临床研究首例受试者给药,意味着公司又一个重要里程碑达成,特别是在全球药物开发。我们将努力推进这个同一主方案的国际多中心临床1/2a期研究,以支持将来该产品可以在不同国家同时获得上市批准和商业化。” 辉大基因联合创始人、总裁兼大中华区总经理姚璇博士表示,“这一里程碑突显了我们坚持以临床需求为导向,开发创新型基因治疗药物的信守承诺以及团队强大的执行力。我们期望这项具有全球注册潜力的国际多中心临床试验,可以为全球的RPE65-IRD患者带来变革性的治疗药物。”
关于RPE65突变相关遗传性视网膜营养不良(RPE65-IRD)
遗传性视网膜营养不良(IRD)是一类由基因突变引起罕见致盲性疾病,已报道致病基因超过250个。其中,RPE65基因突变可能会导致Leber先天性黑矇(LCA)、严重的早发性儿童视网膜营养不良(SECORD)、早发性严重视网膜营养不良(EOSRD)或视网膜色素变性(RP),即这些疾病都被认为是RPE65基因突变相关视网膜病变,代表同一疾病的表型连续体。RPE65基因突变相关视网膜病变通常发病于出生至5岁之间,主要临床表征包括夜盲(凝视伴严重夜盲症和眼球震颤)、进行性视野缺失和中心视力丧失。由于RPE65基因突变相关视网膜病变会引起严重和早期视力丧失,也可能会造成语言、社交和行为等其他功能的发育延迟。
关于HG004同一主方案、国际多中心临床试验(NCT05906953;CTR20232920)
本研究(HG00402研究)为一项多国、多中心、多队列、剂量探索、使用同一主方案的临床试验,旨在评估HG004治疗由RPE65突变引起的遗传性视网膜营养不良患者的安全性、耐受性和疗效。主要终点包括不良事件、特定实验室检查和眼科检查。本研究还将通过多亮度移动测试(MLMT)评估视觉功能,受试者将在各种光照水平下进行运动测试评估。主要研究期结束后,受试者将继续接受长期随访评估。欲了解更多信息,请联系:HG00402@huidagene.com或访问http://clinicaltrials.gov
关于辉大基因
辉大(上海)生物科技有限公司(下称“辉大基因”)是一家全球性的临床阶段生物技术公司,专注于设计、改造及开发新型CRISPR基因编辑工具和颠覆性的创新基因疗法。总部位于中国上海,并在美国新泽西设有办公室,辉大基因目标是利用基因编辑技术满足全球患者的切实需求,研发管线涵盖眼科、中枢神经等多个领域。公司临床阶段项目包括HG004治疗RPE65突变相关遗传性视网膜疾病(已获得美国FDA授予孤儿药资格认定和儿科罕见病资格双认定)和HG202( CRISPR/Cas13 RNA编辑疗法)治疗新生血管性年龄相关性黄斑变性(nAMD),公司其他基因编辑管线包括色素性视网膜炎项目HG301(CRISPR/Cas12 DNA编辑)、MECP2 重复综合征(MDS)项目HG204(CRISPR/Cas13 RNA编辑) (已获得美国FDA授予儿科罕见病及孤儿药资格双认定)、杜氏肌营养不良(DMD)项目HG302(CRISPR/Cas12 DNA编辑)等项目。公司基于CRISPR的基因疗法,有望通过从根本上的基因修复,追求将危及生命的疾病治愈,改变基因编辑医学的未来。
更多信息,请访问公司官网:http://www.huidagene.com
或者在领英(LinkedIN)上关注我们:http://www.linkedin.com/company/huidagene

