Your privacy is very important to us. When you visit our website, please agree to the use of all cookies. For more information about personal data processing, please go to Privacy Policy.


辉大基因科学家团队开发出高活性、靶向范围广且高保真的新型CRISPR-Cas12f系统
CRISPR-Cas系统因其简便性及高效性,已被广泛用于基础生命科学研究、遗传疾病治疗及作物性状改良等领域。作为抵御细菌病毒和外源遗传物质侵入的适应性免疫系统,细菌及部分巨噬菌体在亿万年的适应性进化中发展出许多不同的CRISPR-Cas系统,目前已发现超过30种不同的亚型1。II型CRISPR-Cas9和V-A型CRISPR-Cas12a是目前使用率最高的两种CRISPR-Cas系统。但是,Cas9和Cas12a蛋白较大(>1200氨基酸),大小超过AAV递送系统的包装极限,极大地限制了其在体基因治疗中的应用。近年来,V-F亚型CRISPR-Cas12f系统因其极小的体型(约400~700个氨基酸大小)和高特异性而备受关注。然而,现在报导的Cas12f系统在真核细胞中的编辑活性还相对较低,并且其较高的PAM识别特异性导致可靶向范围窄,从而限制了它们的进一步应用2-7。因此,亟待开发新的高活性且可靶向范围更广的CRISPR-Cas12f系统。
2023年4月11日,辉大(上海)生物科技有限公司(简称,辉大基因)创新研究院研发团队在《Nature Communications》期刊发表了题为“Engineered CRISPR-OsCas12f1 and RhCas12f1 with robust activities and expanded target range for genome editing”的研究论文。该研究综合利用生信大数据挖掘、高通量筛选、蛋白质和sgRNA定向改造、PEM-seq脱靶分析技术及体内外基因治疗有效性分析等技术手段,开发了两种在哺乳动物细胞中具有高活性、靶向范围广且高保真的新型CRISPR-Cas12f系统:enOsCas12f1(433 a.a.,识别5’-TTN PAM)和enRhCas12f1(415 a.a.,识别5’-CCD PAM)。基于enOsCas12f1,研发团队进一步开发了可诱导激活的DD-enOsCas12f1、表观编辑器(miniCRISPRoff)和基因表达激活器(denOsCas12f1-VPR)。该研究不仅丰富了基因编辑工具箱,更重要的是对于基因编辑领域进一步迈入“迷你时代”有着特别的意义。

研究人员首先通过高通量哺乳动物细胞功能鉴定平台对34种之前未被报导的CRISPR-Cas12f1系统进行了编辑活性鉴定,从中筛选得到6个具有哺乳动物细胞活性的新型CRISPR-Cas12f1系统。其中,OsCas12f1和RhCas12f1编辑活性最好,且它们都有非常迷你的体型,分别只有433个氨基酸和415个氨基酸。为进一步提高OsCas12f1和RhCas12f1的活性,研究人员对OsCas12f1、RhCas12f1的蛋白和sgRNA分别进行了定向改造,开发得到高活性版本enOsCas12f1和enRhCas12f1。通过头对头比较,发现enOsCas12f1效率远高于已报导活性最好的Cas12f(Un1Cas12f1_ge4.1),部分靶点能实现90%以上的切割效率,并且靶向范围更广(图一)。
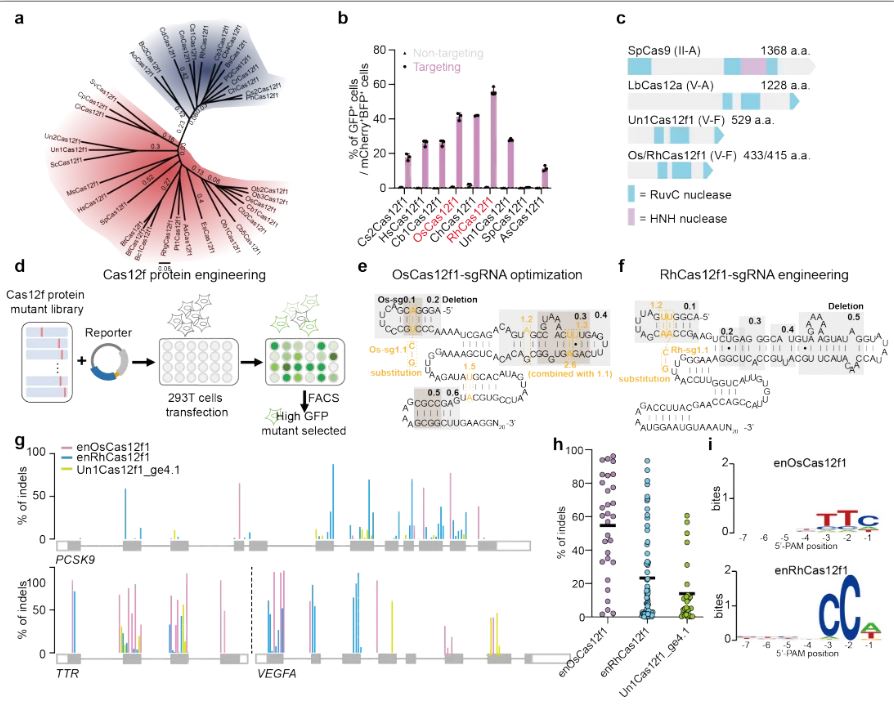
图一. 新型CRISPR-Cas12f的筛选、鉴定及优化
为了解决Cas12f在体内长期表达的潜在风险,研究人员通过将可降解结构域与enOsCas12f1融合,开发得到化学小分子TMP诱导型DD-enOsCas12f1。在人源化DMD模型小鼠体内,研究人员通过单个AAV递送方式发现enOsCas12f1和DD-enOsCas12f1介导的exon51删除能有效恢复dystrophin蛋白的表达。DD-enOsCas12f1的活性在体内受到TMP的调控。值得一提的是,TMP作为FDA认证安全的化学小分子,为DD-enOsCas12f1进一步应用于疾病治疗提供了良好基础。此外,基于enOsCas12f1切割活性缺失突变体——denOsCas12f1,研究人员进一步开发得到表观编辑器(miniCRISPRoff)和基因表达激活器(denOsCas12f1-VPR),并在哺乳动物细胞中验证了其活性,实现了不产生DSB的高效基因表达调控。
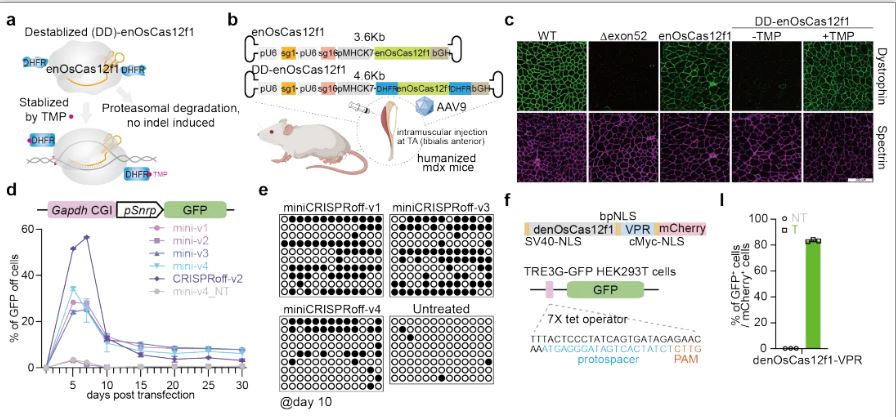
图二. enOsCas12f1和DD-enCas12f1的体内效率验证以及enOsCas12f1的衍生工具开发
辉大基因创新研究院孔祥锋博士、张海南博士、李国玲博士、汪子康博士和孔旭强为本研究论文的共同第一作者,王乐聪等积极参与课题并做出重要贡献。辉大基因创始人&首席科学顾问杨辉研究员、辉大基因创新研究院院长周英思博士为该论文通讯作者。
原文链接:
https://www.nature.com/articles/s41467-023-37829-7
参考文献:

