Your privacy is very important to us. When you visit our website, please agree to the use of all cookies. For more information about personal data processing, please go to Privacy Policy.


辉大基因科学家团队合作发现治疗杜氏肌营养不良症的潜在新方法
大约10%的单基因疾病是由无义点突变引起的,无义点突变产生提前终止密码子(Premature termination codons, PTCs),导致蛋白质截短和突变mRNAs的无义介导的衰变,其中约50%可以通过腺嘌呤碱基编辑器(Adenine base editors, ABEs)的A-G转换逆转。具体而言,A-G转换可以将PTC转换为非终止密码子来恢复蛋白质表达,从而实现PTCs通读。
2022年12月13日,《Journal of Clinical Investigation》期刊在线发表了题为“Mini-dCas13X-mediated RNA editing restores dystrophin expression in a humanized mouse model of Duchenne muscular dystrophy” (IF=19) 的研究论文,该研究由辉大(上海)生物科技有限公司(简称,辉大基因)、中国科学院脑科学与智能技术卓越创新中心(简称脑智中心)及福建医科大学等多单位合作完成。该研究表明,辉大基因拥有自主专利的Mini-dCas13x(13e)介导的RNA碱基编辑系统 (Mini-dCas13x RNA base editing, mxABE)¹可以高效恢复杜氏肌营养不良症人源化DMD小鼠模型中肌萎缩蛋白 (Dystrophin) 的表达。

这项开创性研究由辉大基因首席科学顾问及创始人杨辉研究员课题组、福建医科大学王柠教授和陈万金教授团队、临港实验室/上海脑科学与类脑研究中心胥春龙课题组、中国科学院脑科学与智能技术卓越创新中心和中国农业科学院农业基因组研究所共同合作完成。辉大基因和脑智中心系该论文的第一作者单位;现公司管线开发部李国玲博士,创新研究院肖庆全博士为共同第一作者。辉大基因王兴博士、王豪强和施霖宇博士对该研究亦有重要贡献。
虽然来源于切割酶Cas9的碱基编辑器,已被证明能纠正一些单基因突变,但这些蛋白质通常太大,不能通过单个AAV载体(最大负载大小仅为4.7kb)进行有效的体内递送2。相对其他大尺寸碱基编辑工具,RNA碱基编辑工具具有尺寸较小、可逆性和灵活性等特点的RNA碱基编辑工具已经成为大量开发的焦点,产生了REPAIR、RESTORE、LEAPER、mxABE和其他编辑系统。最近的一项研究表明,RNA碱基编辑器确实可以恢复无义突变终止的蛋白表达。然而该研究仅实现了有限的功能性蛋白表达,而且在治疗的小鼠并没有观察到受损肌肉功能的缓解和运功功能的恢复3。尽管如此,这些研究表明RNA编辑系统可以靶向无义突变诱导的PTCs,意味着RNA编辑可能是治疗单基因疾病更安全,更有效的治疗途径。
在单基因退行性肌肉疾病中,杜氏肌营养不良症(DMD)是第二大最常见的遗传性肌肉疾病。估计每3500~5000名男性新生儿中就有1名受其影响。目前DMD在临床上仍无有效治疗手段,绝大多数患者预后较差,社会负担重。糖皮质激素作为目前指南推荐的唯一具有循证医学证据的药物,虽然适用于所有突变类型的DMD患者,但仅能在一定程度上延缓病情进展,不能逆转DMD的灾难性病程。据统计,60-70%的DMD疾病是由DMD基因外显子缺失引起的。然而,约10%的病例是由无义点突变导致的,这些突变在DMD中引入了PTC,其中40%是UAG,39%是UGA,21%是UAA PTCs。由于DMD是由缺乏功能性dystrophin蛋白引起的,因此从基因或转录水平上恢复dystrophin蛋白的功能或表达是最有效、最根本的治疗方法。
前期,合作单位福建医科大学附属第一医院收治一名具有进行性对称性肌无力、腓肠肌假性肥大、血清肌酸肌酶增高和肌电图呈肌源性损害等症状的患者,作者通过全外显子组测序确定其DMD基因发生c.4174C>T (p.Gln1392*)的无义点突变,随后在人源化DMD小鼠进一步验证了其致病性。由于大部分细胞不表达DMD基因,作者利用携带突变位点的外源性报告载体,对相关DMD无义突变位点进行mxABE系统筛选,并通过肌肉定点注射单个腺相关病毒(AAV9)包装的mxABE系统,发现在人源化DMD小鼠体内高达84%的A-to-G编辑效率,这与之前使用其他RNA编辑方式的研究报告的效率相比至少高出20倍。
为了探索治愈DMD患者的可能性,作者通过系统性注射mxABE至人源化小鼠模型,验证其蛋白恢复水平和功能性恢复情况。研究发现通过AAV全身给药mxABE系统分别将膈肌、胫骨前肌和心肌中的dystrophin蛋白表达平均恢复到WT水平的37%、6%和54%,并明显恢复了小鼠运动功能。总之,本研究利用辉大基因开发的编辑效率更高、体积更小的mxABE系统成功实现人源化DMD小鼠dystrophin蛋白表达,并明显恢复其运动功能。本项目的完成充分彰显辉大基因拥有全球领先的基因小鼠构建平台的实力,可快速高效实现各种疾病模型构建;同时利用先进的基因编辑技术在动物体内进行新药开发相关的安全性和有效性评估,为相关遗传性疾病后续管线开发和治疗提供有力选择。
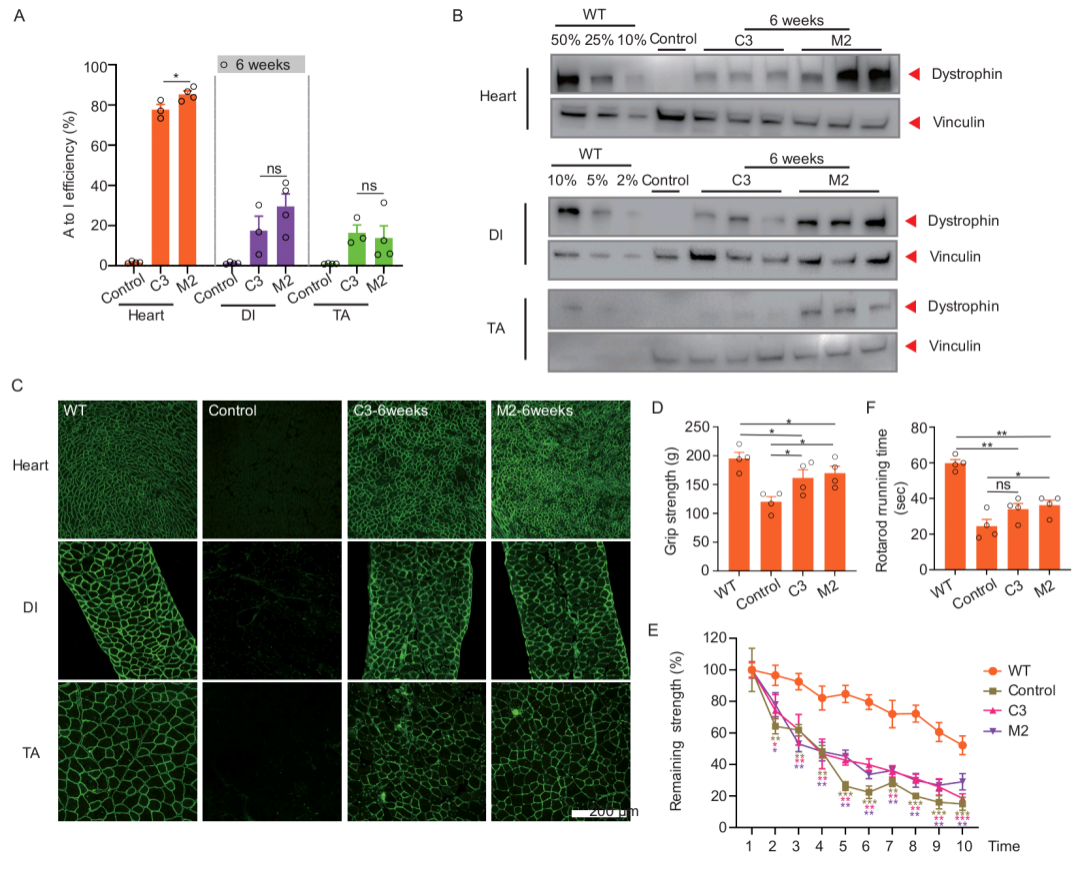
图1 系统性注射mxABE 6周后检测人源化DMD小鼠恢复情况
A.心肌、膈肌和胫骨前肌mRNA A to I碱基编辑效率;B. 心肌、膈肌和胫骨前肌的dystrophin蛋白Western blot分析;C. 心肌、膈肌和胫骨前肌的免疫荧光染色;D. 野生型对照、DMD小鼠模型及不同治疗组前肢抓力检测;E. 野生型对照、DMD小鼠模型及不同治疗组的疲劳测试;F. 野生型对照、DMD小鼠模型及不同治疗组的转棒测试。
原文链接:
http://www.jci.org/articles/view/162809/pdf
参考文献:
1. Xu C, Zhou Y, Xiao Q, He B, Geng G, Wang Z, et al. Programmable RNA editing with compact CRISPR-Cas13 systems from uncultivated microbes. Nature methods. 2021;18(5):499-506.
2. Chemello F, Chai AC, Li H, Rodriguez-Caycedo C, Sanchez-Ortiz E, Atmanli A, et al. Precise correction of Duchenne muscular dystrophy exon deletion mutations by base and prime editing. Science Advance. 2021;7(18):eabg4910
3. Katrekar D, Chen G, Meluzzi D, Ganesh A, Worlikar A, Shih YR, et al. In vivo RNA editing of point mutations via RNA-guided adenosine deaminases. Nature methods. 2019;16(3):239-42.

